中国创新药在2023年迎来海外license out交易大爆发,过去一年中国创新药license out交易金额和交易数量再创新高。
近日,医药魔方数据库披露了2023年中国创新药license out交易TOP15榜单,同创伟业2家成员企业亨利医药、普米斯生物分别荣登总金额榜单TOP8、TOP13;同时普米斯生物在以首付款计的中国创新药license out交易榜单中荣登TOP15。
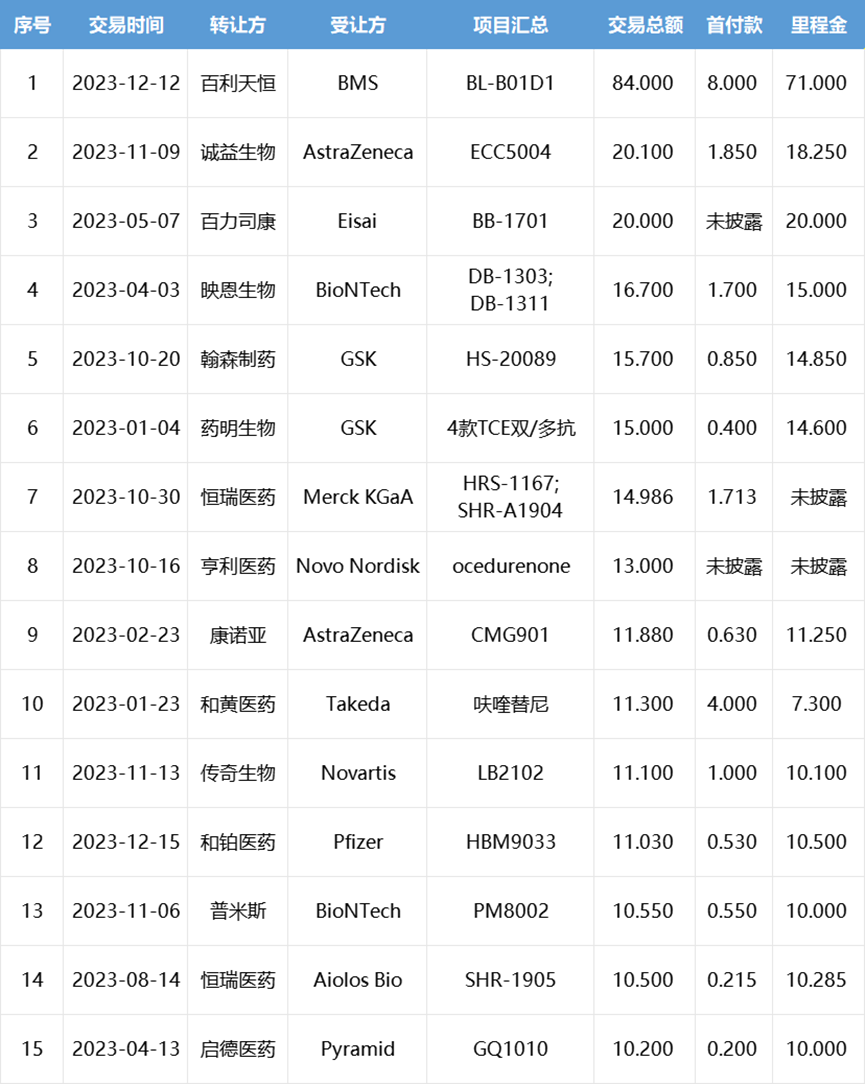
2023年中国创新药license out交易TOP15
(按总金额计,单位:亿美元)
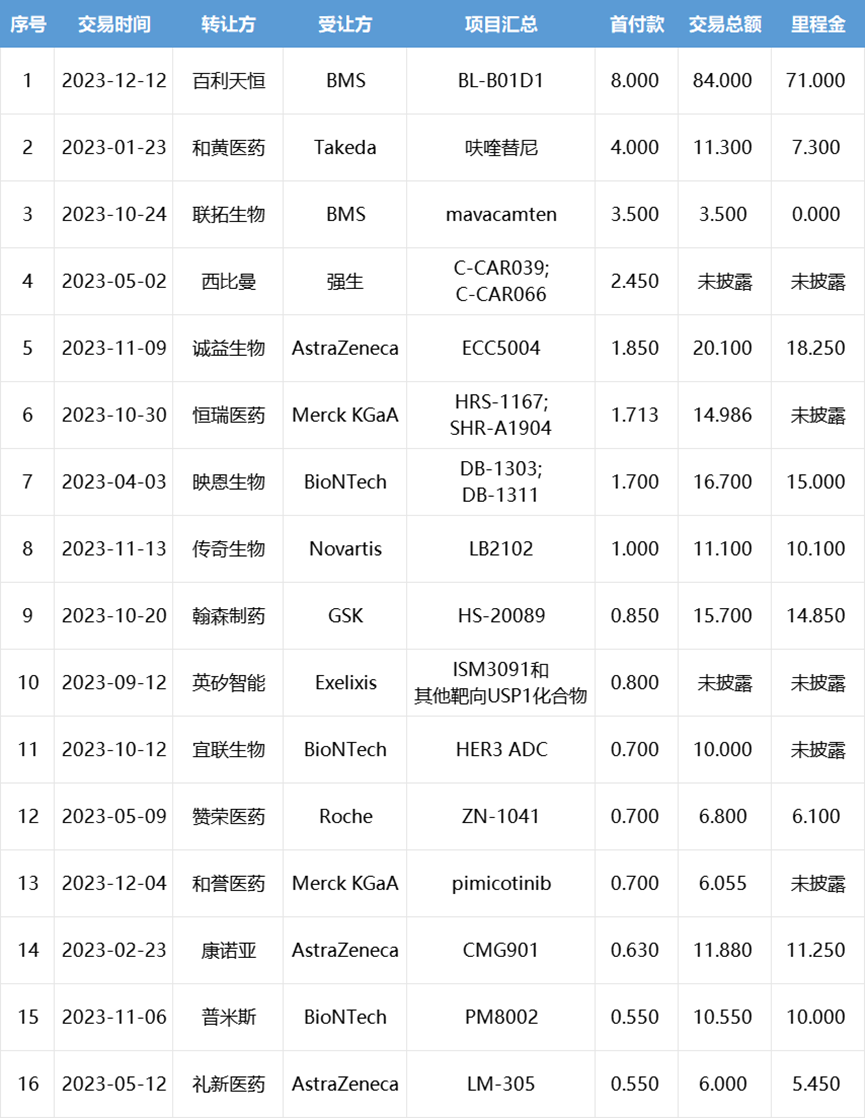
2023年中国创新药license out交易TOP15
(按首付款计,单位:亿美元)
根据医药魔方数据库,今年国内共发生了近70笔创新药license out交易,已披露交易总金额超350亿美元。对比资本市场的冷淡,快速上升的交易热度表明中国创新药企业已经开始进入全球一线舞台,行业基本面已经在摆脱此前fast follow内卷、同质化创新等窘境,逐渐走出新的局面。
相较前几年热钱涌入、大额融资刷屏和高估值带来的泡沫繁荣,这或将是国内创新药企业创新水平质变的标志。其中能够获得较高交易金额以及高额首付(至少过亿美元)的license out则意味着其创新药研发水准已被MNC认可,未来必将获得更坚实的发展基础。同创伟业成员企业亨利医药以13亿美元的交易总额位列榜单TOP8。亨利医药是一家处在临床阶段、致力于新药研发及全球商业化的生物医药公司,专注于心肾和抗感染为主的两大治疗领域。2023年10月16日,诺和诺德宣布引进亨利医药(KBP Biosciences)的慢性肾病高血压药物非甾体盐皮质激素受体拮抗剂(MRA)Ocedurenone,合作总金额高达13亿美元。Ocedurenone是由亨利医药自主研发的一款新型非甾体类选择性盐皮质激素受体拮抗剂(MRA),通过选择性地拮抗盐皮质激素受体,阻止醛固酮发挥作用,促进排尿,阻断RAAS通路,降低血压。迄今为止,Ocedurenone已在九项临床试验中进行了研究,目前正在CLARION-CKD 3期试验中对未控制的高血压和晚期慢性肾脏疾病(CKD)患者进行治疗。3期临床试验CLARION-CKD 计划招募600名晚期CKD和未得到控制的高血压患者,旨在评估Ocedurenone相对于安慰剂治疗的安全性和有效性,预计完成日期为2024年9月。Ocedurenone的优势在于:1)与甾体类MRA(如螺内酯和依普利酮)相比,高选择性的Ocedurenone副作用更小;2)Ocedurenone 具有抗炎和抗纤维化作用,对心肾具有保护作用;3)在控制晚期肾病(3b和4期)方面有很好的作用,具有极低的脱靶效应,如发生高钾血症的风险较低。由于高钾血症的风险增加,特别是当eGFR<45mL/min/1.73 m2和/或血钾>4.5mmol/L时,螺内酯不适用于CKD人群。这一未满足的临床需求有可能被Ocedurenone 所弥补。同创伟业成员企业普米斯生物以10.55亿美元的交易总额位列榜单TOP13。普米斯生物是专注于恶性肿瘤和自身免疫疾病领域创新生物药发现和开发的临床阶段的生物制药公司。2023年11月6日,普米斯生物宣布与BioNTech达成合作协议,将PD-L1/VEGF双抗PM8002的大中华区外全球权益授权给后者,BioNTech支付5500万美元预付款,超10亿美元里程碑金额,以及销售分成。PM8002是一款双特异性抗体候选药物,由人源化的抗PD-L1单域抗体(VHH)融合到一个含有Fc-沉默突变的抗VEGF-A IgG1抗体上构成。通过PD-L1将PM8002分子富集到肿瘤环境中,从而降低全身性阻断VEGF所导致的系统性副作用。2023 ASCO公布的数据显示:(1)单药治疗晚期实体瘤患者的Ib/IIa期安全性和有效性试验中,PM8002总体ORR为16.1%,DCR为74.4%。中位缓解持续时间(DoR)和中位无进展生存期(PFS)分别为7.4个月和5.6个月。此外,安全性良好,治疗相关的不良反应(TRAEs)发生率77.1%,主要以1-2级为主。≥3级的TRAEs发生率20.6%,常见的不良反应(≥10%)主要是丙氨酸转氨酶升高、天冬氨酸氨基转移酶升高、高胆固醇血症、低白蛋白血症、高血压、蛋白尿和贫血等。20多年来,中国医药行业的产业升级一直在默默推进,一路沿着最低端的大宗中间体、原料药到仿制药再到创新药CRO的层级序列努力攀爬,逐渐在每个层级都做到国际认可的领先水平。如今创新药license out爆发,也是多年积累的结果。除了海外license out交易的火热,中国创新药的国内交易和并购同样热度不减。同创伟业成员企业安谛康生物在2023年10月曾宣布获得了先声药业集团(02096.HK)数千万元战略投资并就抗流感创新药ADC189订立合作协议。先声药业将获得ADC189在中国的独家商业化权益,并全面加速ADC189产品临床研究、产业化和商业化进程。ADC189是PA核酸内切酶抑制剂,与玛巴洛沙韦同属于新一代抗流感新药,较奥司他韦更早的抑制流感病毒复制。ADC189是具有全球知识产权的国家1类创新候选药物,正在开展III临床研究。ADC189对甲型和乙型流感病毒均有效,包括对奥司他韦(oseltamivir)耐药的流感株和禽流感株(H7N9,H5N1)。抗流感药效比肩玛巴洛沙韦,优于奥司他韦,且具有口服药效不受食物影响的优势。ADC189全疗程仅一次口服“一粒”,及时服用不仅能快速改善患者流感症状,还能及时阻断流感病毒在家人或同事等密接人群传播。II期临床研究结果展现出显著的疗效和较高的安全性。其实早在2022年9月19日,上海复星医药(集团)股份有限公司(“复星医药”,股票代码:600196.SH)宣布,与同创伟业成员企业江苏柯菲平医药股份有限公司签署许可协议,双方将联合开发并由复星医药产业独家商业化盐酸凯普拉生,合作领域包括盐酸凯普拉生口服制剂和普通注射剂的所有可用适应症,双方将在全球范围内开展合作,此次合作科菲平收到了复星医药支付的首付款约5亿元人民币,以及后续高达20亿元人民币的里程碑付款及高额的销售提成。盐酸凯普拉生片是我国首款自主研发的钾离子竞争性酸阻滞剂(P-CAB),P-CAB有着自身独特的抑酸机制。它可以活性形式进入顶壁细胞小管,在酸性环境中具有稳定性,不需要酸激活。质子化的P-CAB会与H+/K+- ATP酶形成非共价键,从而使H+/K+- ATP酶失活,解离速率较慢。此外,盐酸凯普拉生还为P-CAB做了升级,对结构进行了优化。凯普拉生在伏诺拉生结构基础上将吡啶改成带醚链的苯环,改变脂溶性,增强水溶性,进而改变组织分布,提高靶器官胃内分布水平。抑酸机制的优化让盐酸凯普拉生在抑酸效果上表现突出。在抑酸速度上起效快,凯普拉生1.25-1.75小时即可达峰,血浆半衰期6-7.17小时,首剂4小时后可达全效。在抑酸效果上更平稳,凯普拉生单剂量给药抑酸持续超过24小时,60mg凯普拉生单剂量使用,48小时内的抑酸曲线仍保持平稳。在抑酸时间上更持久,P-CAB的半衰期更长,可在体内留存的时间更长,因此抑酸的时间也更长,首剂单药即可维持超过24小时甚至可达48小时。对于十二指肠溃疡患者关心的溃疡愈合率,盐酸凯普拉生也表现不错,相关研究显示,凯普拉生用于DU患者6周的溃疡愈合率达94.44%,用于DU患者4周的溃疡愈合率达83.89%,达成有效治疗。2023年12月13日,国家医疗保障局公布了2023年《国家基本医疗保险、工伤保险和生育保险药品目录》,盐酸凯普拉生片成功进入国家医保药品目录,将进一步减轻患者的经济负担,开启酸相关疾病治疗新篇章。从陆续披露的诸多交易来看,中国Biobech的管线质量已取得了长足的进步,其前沿性、IP力还是研究质量,都做到了行业一线以及头部药企的青睐。事实上,中国创新药的真实水平有其内在成长逻辑和节奏,前几年未曾因资本过度热捧就实现超水平发育,近两年也不会因为资本过渡冷漠就停滞不前,创新能力独到的Biotech公司必将被“看到”,我们大有可能在国际舞台上占据越来越重要的角色。未来伴随着创新水平的提升,希望借助资本市场乃至国家力量在更高层面介入支持,国内能够成长出更多全球一流的中国生物技术公司和创新药品种。